تنتقل الإلكترونات في الخلية الجلفانية من الكاثود إلى الأنود صح أم خطأ؟ الكثير من الأسئلة التي تدور حول (خلية غلفانية)، وهي من الخلايا التي تحول الطاقة الكيميائية إلى كهربائية، وهي من بين الأسئلة التي يكثر البحث عنها عند الطلاب في المدارس بالمملكة العربية السعودية وغيرها، فما هي الخلفية الجلفانية، وهل صحيح الإلكترونات في الخلية الغلفانية من الكاثود إلى الأنود؟ وكيف تنتقل الإلكترونات في الخلية الجلفانية؟
ملخص الخلايا الجلفانية
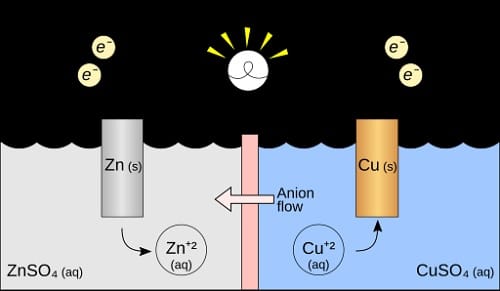
الخلية الجلفانية أو الغلفانية Galvanic cell، هي نوع من الخلايا electrochemical التي عن طريقها يمكننا تحويل الطاقة الكيميائية إلى طاقة كهربائية عبر تفاعلات الأكسدة والاختزال، وتتكون الخلية الجلفانية من قطبين هما: (الأنود والكاثود) وكلاهما مغمور في محلول إلكتروليتي، باختصار الخلية الجلفانية هي جهاز يحول الطاقة الكيميائية إلى طاقة كهربائية من خلال تفاعلات (الأختزال والأكسدة).
- الأنود: هو القطب السالب، يحدث فيه الأكسدة وفيه يتم فقدان الإلكترونات.
- الكاثود: وهو القطب الموجب، يحدث فيه الاختزال ومن خلاله يتم اكتساب الإلكترونات.
- المحلول الإلكتروني: يحتوي على أيونات تساعد في نقل الشحنة.
تنتقل الإلكترونات في الخلية الجلفانية من الكاثود إلى الأنود صح أم خطأ؟
مبدأ عمل الخلية الجلفانية يتم عن طريق تأكسد المواد في (الأنود) القطب السالب، وتعمل على تحرر الإلكترونات، ومن ثم تنتقل الإلكترونات عبر الدائرة الخارجية وهي القطب الموجب (الكاثود) وفي هذا القطب تكتسب الإلكترونات مما يؤدي إلى حدوث اخترال وتأكسد وهو أشبه ما يوصف بـ (المصعد والمهبط في الخلية الجلفانية)، ويتم استخدام الخلايا الغلفانية في البطاريات والعديد من التطبيقات الكهربائية، فهو من بين استخدامات الخلايا الجلفانية.
وهي نفس عمل خلية دانيال وهي من الخلايا الكهروكيميائية، والتي تعمل على تحويل الطاقة الكيميائية إلى طاقة كهربائية عبر ربط قطبين مُختلفين.
إجابة السؤال النموذجي: تنتقل الإلكترونات في الخلية الجلفانية من الكاثود إلى الأنود (العبارة خطأ)، حيث تنتقل الإلكترونات من الأنود إلى الكاثود. الأنود هو القطب السالب حيث تحدث الأكسدة، بينما الكاثود هو القطب الموجب حيث تحدث الاختزال.
تفقد الإلكترونات من قبل بعض المواد خلال نصف تفاعل الاختزال
الإجابة هي خطأ، خلال نصف تفاعل الاختزال، تكتسب المواد الإلكترونات بدلاً من فقدانها، فالأكسدة هي العملية التي تفقد فيها المواد الإلكترونات، بينما الاختزال هو العملية التي تكتسب فيها المواد الإلكترونات.
ما وظيفة القنطرة الملحية في الخلية الجلفانية
وظيفة القنطرة المحلية في الخلايا الغلفانية هي الحفاظ على استمرارية العملية الكهروكيميائية، حيث القنطرة الملحية هي عنصر مهم في الخلية الجلفانية، وهي تقوم بعدد من الوظائف وهي كالتالي:
- الحفاظ على توازن الشحنات داخل الخلية عن طريق السماح بتدفق الأيونات بين المحلول الإلكتروني في كل من الأنود والكاثود، هذا يمنع تراكم الشحنات في أحد الأقطاب.
- تسمح القنطرة الملحية بانتقال الأيونات مثل: أيونات الصوديوم أو البوتاسيوم من محلول إلى آخر، مما يسهل التفاعلات الكيميائية ويساهم في استمرارية تدفق التيار الكهربائي الذي نستفيد منها الحياة اليومية.
- الحفاظ توازن الشحنات وتحسين كفاءة وفاعلية الخلية الغلفانية وزيادة فترة عملها للحصول على طاقة نظيفة يستفاد منها بشكل مستمر.
اقرأ المزيد: يتم تخزين البيانات في النظام باستخدام نظام
ختاماً، تعرفنا في مقال اليوم على إجابة السؤال، تنتقل الإلكترونات في الخلية الجلفانية من الكاثود إلى الأنود صح أم خطأ؟، وقد شرحنا أن العبارة خطأ، حيث تنتقل الإلكترونات من الأنود (القطب السالب) إلى الكاثود (القطب الموجب) عن طريق عمليتي الأكسدة والاختزال بتحويل الطاقة الكيميائية إلى طاقة كهربائية نستفيد منها في شحن البطاريات وغيرها من المواد الأخرى.
الأسئلة الشائعة حول الإلكترونات في الخلية الجلفانية
كيف تنتج الخلايا الجلفانية تيارا كهربائيا؟
الخلايا الجلفانية، أو الخلايا الفولتائية، تنتج تيارًا كهربائيًا من خلال تفاعل كيميائي يحدث داخل الخلية، حيث تحتوي الخلية الجلفانية على مادتين مختلفتين (أقطاب) تعمل كأنود وكاثود. الأنود هو القطب الذي يحدث فيه الأكسدة (فقدان الإلكترونات)، بينما الكاثود هو القطب الذي يحدث فيه الاختزال (كسب الإلكترونات).
ما نوع التفاعل في الخلية الجلفانية؟
في الخلية الجلفانية، يحدث تفاعل أكسدة واختزال (redox reaction). في هذا النوع من التفاعل، يتم أكسدة أحد المواد (فقدان الإلكترونات) بينما يتم اختزال مادة أخرى (اكتساب الإلكترونات).
ما هو القطب الموجب في الخلية الجلفانية؟
في الخلية الجلفانية، القطب الموجب يُعرف بالمهبط (cathode). عند هذا القطب، يحدث اختزال (اكتساب الإلكترونات). في الخلايا الجلفانية، يكون المهبط هو الموقع الذي تذهب إليه الأيونات الموجبة من المحلول، حيث تتفاعل مع الإلكترونات التي تأتي من الدائرة الخارجية.
********************************

